Chimica organica/Cose da fare
Intro
modificaQuesta pagina non è destinata ad essere ben scritta secondo gli standard dei wikibooks, poiché riporta un semplice elenco di tutte le parti del libro di organica che è necessario approfondire.
Richiami di chimica generale
modificaIntermedi delle reazioni: carbeni
modifica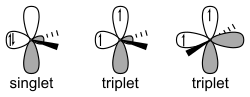
Esempio di carbene isolato [1] (carbeni N-eterociclici)

È un carbene la forma attiva del coenzima tiamin pirofosfato (TPP), derivato dalla vitamina B1 usato nelle cellule animali e vegetali per catalizzare svariate reazioni tra cui la decarbossilazione e la deidrogenazione del piruvato nella fermentazione e respirazione cellulari, rispettivamente.

Reattività differente singoletto/tripletto

Carbenoidi

Reazioni organometalliche
modificaLegame Carbonio-Metallo
| Gruppo 1 | Gruppo 2 | Gruppo 12 | |||
|---|---|---|---|---|---|
| C-Li | 43 | ||||
| C-Na | 47 | C-Mg | 35 | C-Al | 22 |
| C-K | 51 | C-Ca | 43 | C-Zn | 18 |
Metallazione
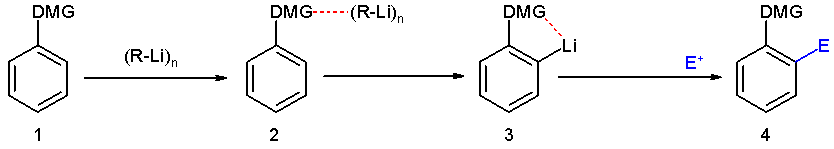
modificaOrto-metallazione[2]
Condensazioni con Palladio
modificaSono reazioni catalizzate dal palladio per l'accoppiamento di carboni ibridizzatisp2 e sp. A seconda delle unità che sono assemblate, si distinguono
- Heck, tra alchene e alogenuro (o pseudoalogenuro) vinilico o arilico
- Suzuki, tra un aril- o vinil borato ed un alogenuro (o pseudoalogenuro) vinilico o aromatico
- Stille, tra un alchilstagno e un alogenuro (o pseudoalogenuro) vinilico o aromatico

Condensazione benzoinica
modificaEsempio di catalisi nucleofila e Umpolung Essa è catalizzata selettivamente dallo ione cianuro CN-
Una caratteristica da notare è che grazie alla presenza di gruppi elettron-attrattori CN e fenile (che tra l'altro possono delocalizzare una carica adiacente), il carbonio carbonilico diventa fortemente acido, al punto tale che esso può portare una carica negativa, comportandosi poi da nucleofilo.
Questa inversione di comportamento da elettrofilo a nucleofilo o viceversa, è detta inversione della polarità o, con termine tedesco, Umpolung [3]
Tautomeria
modificaI composti con idrogeni acidi in α a gruppi insaturi elettron-attrattori possono perdere il protone acido dando un carbanione stabilizzato per risonanza; quest'ultimo può essere ri-protonato o all' atomo originario oppure all'altro atomo che porta la carica negativa in una delle forme canoniche di risonanza. Nel primo caso si ottiene la molecola di partenza, mentre nell'altro si ottiene un'altra molecola che è in equilibrio con la prima. I due composti, isomeri ma distinti, vengono allora detti tautomeri.
La principale forma di tautomeria coinvolge i chetoni e le aldeidi con idrogeni in α (composti carbonilici enolizzabili), la tautomeria cheto-enolica, ove il composto carbonilico è in equilibrio con un alcol vinilico (enolo). Un esempio è il metiletil chetone (1) e il 2-bunten-2-olo (2)

I tautomeri sono in principio separabili, ma —tranne che in completa assenza di acidi o basi anche in tracce— si interconvertono rapidamente. La forma chetonica è la più stabile termodinamicamente. Il rapporto enolo/chetone varia con secondo la molecola e le condizioni. In generale, più il gruppo insaturo è elettron-attrattore (ovvero più l'α-idrogeno è acido e l'anione stabilizzato per risonanza) e più le condizioni sono acide, maggiore è la frazione di enolo. Altri fattori che entrano in conto sono l'ingombro sterico, che è alleviato nella forma enolica ove l'angolo di legame è 120°, e la possibilità di legami idrogeno intramolecolari in una delle forme.
| Acetone | CH3COCH3 | 7×10-7% |
| Isobutirraldeide | (CH3)2CH2CHO | 1.4×10 -2% |
| Difenilacetaldeide | Ph2CH-CHO | 9.1% |
| Acetoacetato di etile | CH3C(=O)CH2C(=O)OCH2CH3 | 8.4% |
| Acetilacetone | CH3C(=O)CH2C(=O)OCH2CH3 | 80% |
Altre coppie tautomeriche sono riassunte nella tabella seguente
| A-X-Y=Z con A = H+ | X=Y-Z-A | |
|---|---|---|
| H-C-C=O | C=C-O-H | Tautomeria cheto-enolica |
| H-N-C=O | N=C-O-H | Tautomeria ammide-acido immidico/lattame-lattime |
| H-C-C=N | C=C-N-H | Tautomeria immina-enammina |
| H-N-C=NH | N=C-NH2 | Tautomeria immina-ammina |
Sistematica delle reazioni organiche
modificaVanno risistemate le reazioni per gruppo funzionale
- Sostituzione nucleofila ed eliminazione mono- e bimolecolari
- Reazioni di alcheni ed alchini
- Reazioni degli alcoli
- Eterificazione, sintesi di Williamson
- Alogenazione
- Disidratazione ad alcheni
- Ossidazione ad aldeidi e chetoni
- Reazioni delle ammine e composti azotati
- Alchilazione
- N-Ossidi
- Nitrosazione
- Eliminazione di Hoffman, regola di Saytzeff
- Reazioni dei composti carbonilici ed affini
- Addizione al cabonile
- Addizione di ammine: immine ed enammine
- Addizione di composti organometallici
- condensazione aldolica e di Claisen, reazione di Knoevenagel
- Olefinazione di Wittig e modificazione di Horner-Wadsworth
- alfa-Alogenazione, reazione dell'aloformio, reazione di Reformatzkii
- Reazioni nucleofiliche dell'enolo
- Ossidazione
- Riduzione
- Addizione al cabonile
Sintesi di Williamson
modifica
Reazione di Wittig
modifica
La trifenilfosfina è comunemente utilizzata come precursore del sale di fosforio e può essere eliminata per distillazione dalla miscela di reazione (pb 110 °C)
Versione di Horner-Wadsworth-Emmons

Si ottiene in maggioranza l'alchene Il fosfonato è eliminato nel work-up acquoso
Olefinazione di Tebbe Un'ultima variazione usa il reagente di Tebbe, un complesso titanocene-trimetil alluminio che si comporta da donatore di metilene

Le condizioni per l'olefinazione di Tebbe sono meno basiche di quelle della reazione di Wittig (e variazioni).
Reazioni pericicliche
modificaReazione di Diels-Alder
modificaL'alchene (o alchino) che partecipa viene comunemente indicato come dienofilo. Tranne casi molto particolari, è il diene che attacca nucleofilicamente il dienofilo: la reazione è infatti accelerata se il diene porta gruppi elettron donatori ed il dienofilo elettron-attrattori.


Il diene riportato a lato (diene di Danishefsky[6]) nella reazione qui sotto è estremamente ricco in elettroni grazie alle coppie solitarie degli ossigeni che delocalizzano sull'intero sistema π
La reazione è catalizzata anche da acidi di Lewis o metalli di transizione che si legano al dienofilo aumentandone l'elettrofilicità per coordinazione.
Aza-Diels-Alder
modificaw:en:Image:Aza_Diels_Alder.gif
Trasposizione di Cope
modificaTrasposizione orto-Claisen
modificaCicloaddizioni 1,3-dipolari
modifica1,3-dipoli
Cicloaddizione 1,3-dipolare[7]
Base della epossidazione resa popolare da K.B. Sharpless[8]
Epossidazione
modificaCon peracidi organici e perossidi di metalli di transizione (Mo, V)[9]
Asimmetrica di Sharpless [10][11] con Ti o V
Ossidazione
modifica- con acido dicromato/anidride cromica/clorocromato di piridinio (PCC)
- con permanganato
- Con DMSO/dimetilclorosolfonio (Swern, Moffat)

- Dess-Martin, con iodo ipervalente
- ossidazione di Oppenauer
Addizione e sostituzione nucleofila ai gruppi carbonilico e carbossilico
modificaComposti carbonilici α-β insaturi
modifica- Baylis-Hillman

- Reazione di Michael (Addizioni coniugate 1,4
- decarbossilazione
Riduzione con idruri
modificaLitio alluminio idruro (Li+\[AlH4\]-

Sodio boridruro ( NaBH4), meno potente, riduce i gruppi carbonilici ma non i carbossilici
Reazione esplosiva su youtube
modificaSpesso capita che esperimenti spettacolari presentati sotto forma di filmato, magari su youtube, rappresentino un modo coinvolgente per spiegare interessanti aspetti delle reazioni chimiche. Girano su internet una serie di filmati che mostrano bottiglie in plastica gonfiarsi fino ad esplodere quando vengono riempite con acido muriatico ed alcune palline di carta d'alluminio. La reazione chimica coinvolta è la seguente:
2Al(s) + 6HCl(aq) ---> 2AlCl3(aq) + 3H2(g)
che porta alla produzione di tricloruro di alluminio (AlCl3) e di idrogeno (H2). Poiché l'idrogeno molecolare a temperatura ambiente è un gas, tale reazione è completamente spostata a destra, cioè va avanti fino alla completa consumazione di almeno uno dei reagenti (quello presente in difetto). Pertanto la rapidissima produzione di idrogeno gassoso in un volume limitato quale quello della bottiglia di plastica, crea una fortissima pressione che finisce per a far esplodere il recipiente. Va da se che ripetere questo esperimento è una cosa veramente pericolosa, e dunque da evitare.
Composti naturali
modificaCarboidrati
modificaIl passaggio da emiacetale ad acetale va disegnato passaggio per passaggio, con particolare riferimento all'attacco da parte di H+ con liberazione di acqua e formazione del carbocatione.
Chitina
modificaLa chitina è la seconda sostanza organica per abbondanza al mondo, poiché costituisce l'esoscheletro degli insetti e dei crostacei. Per questo è opportuno fornirne almeno una breve descrizione.
- ↑ Arduengo A.J.; Harlow R. L. and Kline M., J. Am. Chem. Soc. 1991, 113(1) 361-363, DOI 10.1021/ja00001a054
- ↑ Directed ortho metalation. Tertiary amide and O-carbamate directors in synthetic strategies for polysubstituted aromatics Victor Snieckus Chem. Rev.; 1990; 90(6); 879-933. Abstract
- ↑ Seebach D., "Methods of reactivity Umpolung", Angew. Chem. Int. Ed. 1979, 18, 239 DOI:10.1002/anie.197902393
- ↑ H. Mimoun, "Oxygen Transfer from Inorganic and Organic Peroxides to Organic Substrates: A Common Mechanism?", Angew. Chem. Int. Ed. 1982, 21 (10) 734 - 750
- ↑ Johnson, R. A.; Sharpless, K. B. Comp. Org. Syn. 1991, 7, 389-436. (Review)
- ↑ Danishefsky, S. J; Kitahara, T. "Useful diene for the Diels-Alder reaction." J. Am. Chem. Soc. 1974, 96, 7807-7808. DOI: 10.1021/ja00832a031
- ↑ Huisgen, R. "Kinetics and Mechanism of 1,3-Dipolar Cycloadditions",Angew. Chem. Int. Ed. 1963, 2(11), 633–645 DOI 10.1002/anie.196306331
- ↑ Kolb H. C., Finn M. G. and Sharpless K. B., "Click Chemistry: Diverse Chemical Function from a Few Good Reactions", 2001 Angewandte Chemie International Edition, 40(11), 2004–2021 DOI 10.1002/1521-3773(20010601)40:11<2004::AID-ANIE2004>3.0.CO;2-5
- ↑ Mimoun, H. Angew. Chem. Int. Ed., 1982, 21, 734-750
- ↑ Katsuki, T.; Sharpless, K. B. J. Am. Chem. Soc. 1980, 102, 5974. (DOI: 10.1021/ja00538a077)
- ↑ Hill, J. G.; Sharpless, K. B.; Exon, C. M.; Regenye, R. Org. Syn., Coll. Vol. 7, p.461 (1990); Vol. 63, p.66 (1985). (Article)
wikipedia:da:Click chemistry wikipedia:de:Click-Chemie wikipedia:en:Click chemistry wikipedia:ja:クリックケミストリー wikipedia:zh:点击化学