Chimica organica/Alcani (Proprietà)
Come verificare la stabilità relativa di due molecole
modificaIn questo capitolo, dedicato alla termodinamica chimica, abbiamo visto come l'energia interna di una molecola non possa essere misurata, ma possa esserlo la differenza di energia interna tra tale molecola ed un'altra ottenuta da essa tramite una serie di reazioni. Ecco perché una delle strade più percorse per verificare la stabilità relativa di due molecole organiche consiste nel trasformarle, attraverso reazioni chimiche, nella stessa sostanza, più stabile di entrambe, quantificando l'energia liberata nei due casi. La specie che per trasformarsi libera meno energia è la più stabile.
Gli alcani (CnH2n+2) in presenza di un eccesso di ossigeno ed elevate temperature reagiscono con l'O2 per formare nCO2 e (n+1)H2O con reazione esotermica (combustione), cioè con produzione di calore. Questa razione risponde pienamente allo scopo.
| Introduzione |
| Esempio di reazione redox | Formazione di Ruggine | Ossidazione di molecole organiche |

|

|

|
Come detto in maggior dettaglio in questa sezione di wikipedia inglese, le ossido-riduzioni, dette anche per brevità redox, sono reazioni che comportano un cambio nel numero di ossidazione degli atomi coinvolti.
La loro complessità può raggiungere livelli molto elevati, come nel caso dell'ossidazione degli zuccheri nel corpo umano, che avviene attraverso un complicato processo di trasferimento di elettroni attraverso molte specie. La maggior parte delle reazioni di ossidoriduzione osservate nei corsi di base di chimica generale, tuttavia, comporta la modifica del numero di ossidazione di due soli atomi, attraverso lo scambio di elettroni. Queste possono pertanto essere suddivise in due parti:
- una Ossidazione, che descrive la perdita di elettroni da parte di una molecola, un atomo o uno ione
- una Riduzione, che descrive il conseguente acquisto dei medesimi elettroni da parte di una molecola, un atomo o uno ione
Riduzione
Ossidante + e- --> prodotto
(la specie guadagna elettroni, il suo numero di ossidazione diminuisce)
Ossidazione
Riducente --> prodotto + e-
(la specie perde elettroni, il suo numero di ossidazione aumenta)
- Da approfondire
- Le reazioni che coinvolgono i lagami covalenti sono di ossido-riduzione pur non comportando scambio di elettroni.
- Le reazioni di Metathesis non sono di ossidoriduzione pur comportando scambio di eleetroni.
| Come rappresentare una redox |
I processi che avvengono durante una reazione di ossidoriduzione possono essere discussi con semplicità se la reazione viene suddivisa nelle due parti di Ossidazione e Riduzione. La reazione
- ,
ad esempio, può essere convenientemente suddivisa in
Poiché la carica complessiva delle specie in gioco non cambia, ad un guadagno di elettroni nella reazione di ossidazione corrisponde un pari consumo di elettroni nella reazione di riduzione.
Gli elementi, anche in forma molecolare, hanno numero di ossidazione pari a zero. Nella prima metà della reazione l'idrogeno è ossidato, così che il suo numero di ossidazione passa da zero a +1. Nella seconda parte il fluoro è ridotto, così che il suo numero di ossidazione passa da zero a -1.
quando le due mezze reazioni sono osservate assieme, gli elettroni si elidono ...
... e gli ioni si combinano a dare acido fluoridrico:
| Alcuni esempi |
- il Ferro(II) si ossida a Ferro(III):
- Fe2+ → Fe3+ + e−
- L'acqua ossigenata si riduce a ione idrossido in presenza di un acido:
- H2O2 + 2 e− → 2 OH−
Tali equazioni possono essere rappresentate complessivamente:
- 2Fe2+ + H2O2 + 2H+ → 2Fe3+ + 2H2O
- nella denitrificazione, l'anione nitrato si riduce a azoto in presenza di un acido:
- 2NO3− + 10e− + 12 H+ → N2 + 6H2O
- Nella formazione di ruggine il ferro si ossida e l'ossigeno si riduce a dare ossido di ferro(III):
- 4Fe + 3O2 → 2 Fe2O3
| Combustione |
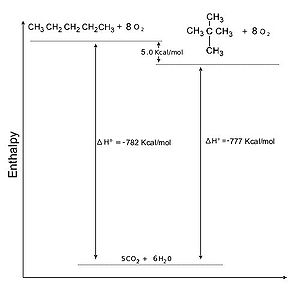
Naturalmente maggiore è la lunghezza della catena dell'alcano, maggiore è il calore che viene prodotto. La stabilità di due alcani a peso molecolare diverso può dunque essere confrontata dividendo il calore totale sprigionato per il numero dei carboni che compongono la catena. È da notare come contemporaneamente al calore sviluppato aumenti anche la temperatura di attivazione della reazione: gli alcani a peso molecolare sopra il C30 sono cattivi combustibili. Un esempio è dato dal bitume.
Alcani: Calore di combustione degli isomeri
modificaDalla tabella sopra sembra di poter ricavare, come regola generale, che gli isomeri più ramificati degli alcani liberino una minore quantità di calore (a parità di numero di carboni) rispetto ai corrispondenti lineari. Questo dato sperimentale può essere interpretato notando come la combustione comporti non solo la scissione dei legami di tipo σ che legano i nuclei delle singole molecole, ma anche l'annullamento delle forze attrattive tra molecole. Poiché queste sono inversamente proporzionali alla dimensione delle molecole, gli alcani ramificati, più compatti, sono caratterizzati da forze intermolecolari più deboli e quindi liberano meno calore se bruciati.
La tensione d'anello nei cicloalcani
modificaPoiché i cicloalcani sono caratterizzati da un numero diverso di atomi di carbonio, un confronto sulla loro stabilità relativa può essere basato sul calore di combustione sviluppato solo dividendo tale quantità per il numeri di carboni. Il calore sviluppato per carbonio decresce da ciclopropano a cicloesano, risale dal cicloesano fino al cicloalcano a 15 carboni (pentadecano), poi si stabilizza. I carboni che compongono un alcano sono ibridati sp3, così che i gruppi ad essi legati tendono a formare angoli di 109.5 gradi tra loro. La configurazione ad anello impedisce ai cicloalcani dai 3 ai 15 carboni, con l'eccezione del cicloesano, di disporre i protoni in modo sfalsato gli uni rispetto agli altri, generando quella che viene definita tensione d'anello.
| ||||||||||||||||||||||||||||||||||||||||||||||||||
| Calore di combustione liberato da una mole di cicloalcano. La tensione d'anello è calcolata sottraendo il ΔH25º per unità di CH2 del cicloesano al medesimo ΔH di ciascun alcano; tale numero è poi moltiplicato per il numero di unità CH2 che differenzia l'alcano considerato dal cicloesano. |
Caso cicloesano
Il cicloesano, se in conformazione planare, non fa eccezione. Esistono tuttavia due conformazioni perfettamente compatibili con l'ibridazione sp3 dei carboni: quelle a sedia. Si parla di conformazioni poiché per passare dall'una all'altra sono necessarie solo rotazioni di legami σ. La figura, coerentemente, le mostra in equilibrio tra loro
Proiettare il cicloesano secondo Newman evidenzia il fatto che i protoni siano perfettamente sfalsati.
Nelle conformazioni a sedia è possibile notare come 4 carboni identifichino un piano. Rispetto a questo si possono notare idrogeni protesi verso l'alto e verso il basso. Quelli diretti al di sopra del piano sono alternativamente rivolti perpendicolarmente rispetto al piano stesso (assiali) e quasi parallelamente (equatoriali). La stessa cosa vale per quelli diretti al di sotto del piano.
La rappresentazione di Newman mostra come un gruppo in direzione equatoriale si trovi al di sopra del piano costituito dai carboni quando il gruppo in assiale legato al medesimo carbonio sia diretto in basso.
| Conformazioni a sedia del cicloesano | Cicloesano visto con proiezione di Newman |

|

|
Ciclopropano e legami curvi
modificaNel ciclopropano l'angolo formato dai legami C-C è solamente di ~60°, ben inferiore al classico angolo tetraedrico sp3 di 109.5° o quello p-p di 90°. Gli orbitali di legame, che hanno un forte carattere s, si trovano ad essere al di fuori del "triangolo" molecolare.

Il legame curvo è anche descritto come un legame misto σ / π, il che spiega la capacità di un anello ciclopropanico in una molecola di stabilizzare un catione adiacente, in modo analogo ad un doppio legame (proprietà condivisa con i cosiddetti ioni non-classici w:en:Non-classical ion)
L'anello è sotto forte tensione e la molecola reagisce quando possibile per aprirsi. Il ciclopropano puro può detonare a temperatura ambiente perché le collisioni molecolari hanno già energia sufficiente per scatenare l'apertura dell'anello.
Approfondimenti
modifica- Software gratuiti
- Arguslab permette, tra le molte funzioni di cui dispone, di calcolare le energie che caratterizzano le molecole organiche e di disegnare gli orbitali molecolari